Continuando con las técnicas de análisis de los productos lácteos, se expone seguidamente la metodología analítica para la
detección de grasa vegetal en la mantequilla.
Principios y fundamentos metodológicos.
Los
digitónidos de esterol se disuelven en una mezcla de formamida y
N,N-dimetilformamida, extrayendo con n-pentano los esteroles liberados, que se separan por cromatografía de gases. Si en el cromatograma obtenido se registra un pico con el tiempo de retención correspondiente al beta-sitosterol, se confirma la presencia de grasa vegetal en la
muestra de mantequilla examinada.
Material y aparatos utilizados.
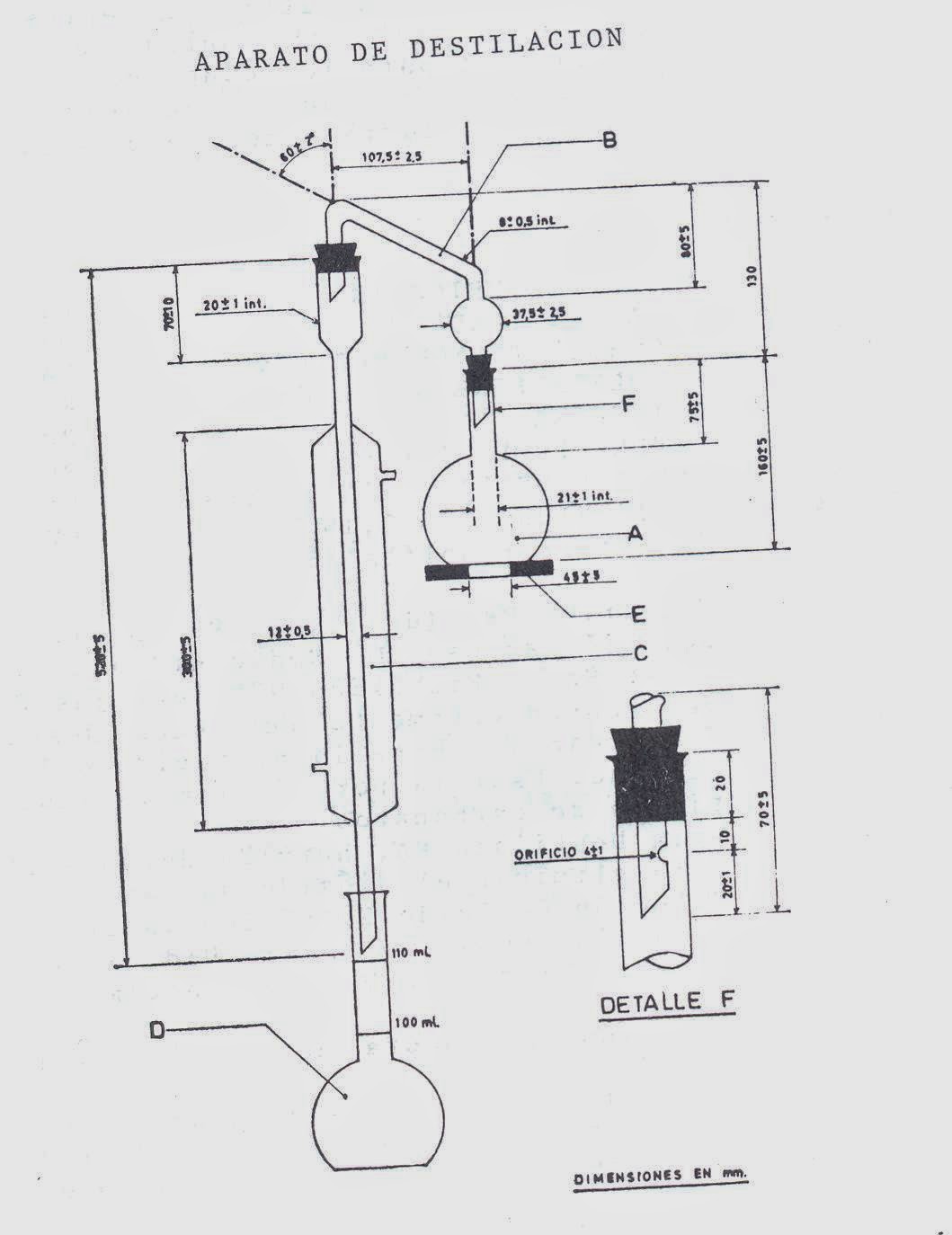
-Cromatógrafo de gases, equipado de un detector de ionización
de llama, un inyector de plata o de vidrio con un sistema de
inyección directa en la columna, y un registrador.
-Columna de cromatografía de gases, de vidrio o de acero
inoxidable, en forma de U o en espiral, de 1 o 2 m de longitud, y un diámetro interior 3-4 mm. Se recomienda el vidrio, pues algunos
tipos de acero inoxidable dan resultados erróneos por alteración de
los esteroles.
-Microjeringa, para dosificaciones de 5 o 10
microlitros.
Reactivos necesarios.
-Agua destilada (PA).
-Alcohol etílico al 96% (v/v, PA).
-Colesterol (DC).
-Digitonina en solución alcohólica al 1%.
-N,N-Dimetilformamida (PA).
-Éter etílico (PA).
-Fitosterol de aceite de colza.
-Fitosterol de aceite de soja.
-Formamida (PRS).
-n-pentano (PA).
-Potasio hidróxido al 85% en lentejas (PA).
Se prepara una mezcla con volúmenes iguales de formamida (PRS) y
N,N-Dimetilformamida (PA). En el relleno de la columna la fase estacionaria es de goma de silicona
(típo metílico), estable hasta al menos una temperatura de 300 ºC que impregna en
m2 a 4% una tierra de diatomeas calcinada, lavada al ácido y
silanizada, de granulometría 80/100 o 100/120 de malla.
La solución para el ensayo de sensibilidad se prepara con 1 mg de colesterol (DC) de 1 ml de n-pentano (PA), recientemente obtenido a partir de la grasa
de leche, del modo que se describe en el apartado del procedimiento analítico de los esteroles (punto 2).
La solución para el ensayo de resolución de los picos se prepara con 0,9 mg
de fitosterol de aceite de colza y 0,1 mg de colesterol (DC) en 1 ml de
n-pentano (PA). Los esteroles deben ser de reciente preparación, según el procedimiento analítico descrito (punto 2).
Asimismo, la solución para el ensayo de referencia se prepara con 1 mg de fitosterol de aceite de soja en 1 ml de n-pentano (PA) recientemente preparado, según
se describe en el procedimiento analítico descrito (punto 2).
Como gas portador se utiliza el nitrógeno. También se utiliza el hidrógeno y el oxígeno (o aire).
Procedimiento analítico.
1.Preparación de la muestra: Fundir aproximadamente 50 g de la
muestra de mantequilla en una estufa estándar a una temperatura inferior
a 50 ºC, hasta conseguir la separación de las fases acuosa y grasa. Seguidamente, se separa la
capa grasa por decantación y se procede a su clarificación en la estufa a una temperatura de unos 40 ºC; después se filtra sobre un papel de
filtro seco, evitando el paso de la fase acuosa por el filtro.
2.Preparación de los esteroles: En un matraz erlenmeyer
de 500 ml pesar aproximadamente 15 g de materia grasa, con una precisión
de 0,1 g. Añadir 10 ml de solución de potasio hidróxido y 20 ml de alcohol etílico al 96% (v/v, PA). Colocar sobre el matraz erlenmeyer el
refrigerante de aire, calentar en baño de agua hirviendo, agitando
por rotación, hasta que la solución se vuelva clara, y continuar la
ebullición durante 30 minutos más. Añadir 60 ml de agua destilada (PA), y luego 180 ml de alcohol etílico al 96% (v/v, PA) y elevar la temperatura a unos 40 ºC; añadir 30 ml de la solución alcohólica de dgitonina al 1%, agitar y dejar
enfriar. Colocar el matraz en un refrigerante regulado a la temperatura de 5 ºC,
aproximadamente, durante 12 horas o toda la noche. Recoger el precipitado del digitónido de esterol por filtración
sobre un papel de filtro de velocidad media utilizando un embudo Buchner (8 cm
de diámetro). Lavar el precipitado con agua destilada aproximadamente a unos 5 ºC de temperatura hasta que el filtrado no forme espuma; después se lava una vez con 25-50 ml de alcohol etílico al 96% (v/v, PA), y una vez con 25-50 ml de éter etílico (PA). Desecar el papel de filtro con el precipitado en un vidrio de reloj
en estufa a 102
± 2 ºC,
durante 10 o 15 minutos. Separar el precipitado en forma de película,
plegando en dos partes el papel de filtro. Disolver en un pequeño tubo de
ensayo, aproximadamente
, 10 mg
de digitónido
de esterol
en 0,5 ml
de
una mezcla de volúmenes iguales de formamida
(PRS)
y
N,N-Dimetilformamida
(PA)
. En caso necesario, calentar ligeramente, enfriando después. Añadir 2,5 ml
de n-pentano
(PA)
y agitar; dejar
reposar hasta que la separación entre las capas sea nítida, y usar la
capa superior para el análisis cromatográfico, ya que
contiene los esteroles
liberados.
3.Condiciones de la
cromatografía de gases: La temperatura de la columna será de 220-250 ºC., la temperatura del sistema de inyección, si éste puede calentarse por
separado, debe ser 20-40 ºC superior a la de la
columna, y el gasto de nitrógeno se fija en 30/60 ml
/min
. Se debe desconectar el detector y equilibrar las
columnas nuevas en estas condiciones durante 16-24 horas. Seguidamente, se conecta el
detector, se enciende la llama, regulando el gasto de hidrógeno y
de oxígeno
o de aire con objeto de obtener una altura de llama y una sensibilidad
adecuada.
Poner en marcha el registrador y dejar que el papel se desenrolle a
una velocidad adecuada, ajustar el cero y el atenuador
. Si la línea
de base es estable, el aparato está preparado para su utilización.
4.Ensayo de sensibilidad: Inyectar de 3 a 5 ml de la solución para el ensayo de sensibilidad, preparada previamente, apareciendo sólo un pico de colesterol en el cromatograma obtenido (figura 1). Ajustar el atenuador de modo que se utilice aproximadamente toda la escala del registrador.
Figura 1. Esteroles de la materia grasa de la leche.
5.Ensayo de resolución de los picos: Inyectar de 3 a 5 ml de la solución para el ensayo de resolución de los picos, preparada previamente, apareciendo en el cromatograma los picos de colesterol, brasicosterol, y camposterol (figura 2). A continuación, medir las
distancias de retención (distancia desde el punto de inyección
hasta el punto de altura máxima del pico) para los siguientes picos: colesterol (dch), brasicosterol (db), camposterol (dc), y beta-sitosterol (ds), así como las anchuras de
la base de los picos (dimensión de retención entre las
intersecciones con la línea de base de las tangentes en los puntos de
inflexión situados en la parte anterior y posterior del pico), que corresponden al colesterol (Wch), y al brasicosterol (Wb). La resolución de los picos se expresa mediante la siguiente fórmula:
PR = 2(db
– dch)
(Wb
+ Wch), cuyo valor debe ser al menos igual a 1.
Asimismo, hay que calcular los tiempos de retención
relativos (colesterol 1,00) para el brasicosterol, el camposterol y
el beta-sitosterol.
Figura 2. Esteroles del aceite de colza.
6.Ensayo de referencia: Inyectar 3 a 5 ml de la solución para el ensayo de referencia, preparada previamente, apareciendo en el cromatograma los picos de camposterol, estigmasterol y beta-sitosterol (figura 3). A continuación, medir las distancias de retención de los picos correspondientes al camposterol (dc), estigmasterol (dst), y beta-sitosterol (ds). Calcular los tiempos de retención
relativos, que son, aproximadamente los siguientes:
-Colesterol: 1,00
(aproximadamente 15 minutos).
-Brasicosterol: 1,13-1,15.
-Camposterol: 1,32-1,34.
-Estigmasterol: 1,44-1,46.
-Beta-sitosterol: 1,66-1,68.
Figura 3. Esteroles del aceite de soja.
7.Análisis de la muestra: Inyectar de 3 a 5
ml de la solución a analizar y pulsar el botón del atenuador hasta
obtener un factor de atenuación cuatro veces inferior, que generalmente se obtiene en dos pases del botón. A continuación, registrar el cromatograma obtenido.
Expresión de los resultados.
Si
en el cromatograma obtenido aparece un pico con un tiempo de retención relativo
igual al de beta-sitosterol y una altura que corresponde al menos a
un 2% de la escala, se confirma la presencia de beta-sitosterol y la
muestra de grasa examinada, a partir de la cual se han aislado los
esteroles, se considera que contiene grasa vegetal. La presencia en
el cromatograma de picos de otros fitosteroles como el camposterol o
el estigmasterol, reafirma dicho resultado.
Este método permite detectar la presencia de al menos un 0,5% de
beta-sitosterol en la mezcla de esteroles. En principio, no es posible fijar el límite de detección
de la grasa vegetal en la grasa de leche, debido a que depende del contenido en beta-sitosterol de la grasa añadida, es
decir, de la naturaleza de esta grasa o de la mezcla de grasas
añadidas a la grasa de leche.
Referencias.
-Métodos de análisis. Boletín Oficial del Estado (21/7/1977 y 22/7/1977).
-Norma Internacional FIL-IDF 54: 1970.
-Métodos Oficiales de Análisis en Alimentaria: Leche y Productos Lácteos. Montplet & Esteban, 1987.
José Luis Ares Cea (coordinador de la Planta Piloto de Lácteos, Consejería de Agricultura y Pesca)